ترتيب الأحماض المعدنية من حيث القوة
قوة الأحماض
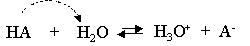
الأحماض المعدنية Mineral acids
يتم الحصول على هذا الحمض من المعادن الغير عضوية عن طريق التفاعلات الكيميائية.
- تتمثل وظيفة الأحماض المعدنية في استخدامها كعوامل حفازة ومساعدة في التفاعلات الكيميائية، كما يتم استخدامها كعوامل تنظيف في صناعة الإلكترونيات.
- تتميز الأحماض المعدنية بسهولة الذوبان في الماء، حيث تكونها متأينة في الماء (مركبات قطبية)، وبالتالي لها شحنات سالبة وموجبة.
- تحتوي معظمها على أحماض قوية، ولكن هناك أحماض معدنية ضعيفة مثل حمض الفوسفوريك.
- تكون معظم الأحماض المعدنية شفافة ورائقة، وعندما يصبح لونها غير واضح، يشير ذلك إلى وجود بعض الشوائب والغازات.
- تتوقف سهولة إطلاق البروتونات من الحمض العضوي على قوته أو ضعفه.
- يسهل العثور على العلاقة بين ثابت قوة الحمض وثابت قوة الأساس لزوج (حمض، أساس مرافق) في الماء.
أمثلة عن الأحماض المعدنية
- حمض الهيدروكلوريك
- حمض النيتريك: HNO 3
- حامض الفوسفوريك: H 3 PO 4
- حامض الكبريتيك : H 2 SO 4
- حمض البوريك : H 3 BO 3
- حمض الهيدروفلوريك: HF
- حمض الهيدروبروميك: HBr
- حمض البيركلوريك: حمض الهيدروكلوريك 4
- حمض الهيدرويوديك
ترتيب الأحماض المعدنية
في الجدول الموضح أدناه، ترتبت الأحماض وقفاً لتناقص قوتها (وهى مقدرتها على منح (H+)، وبفحص الحمض (HClO4) نجد أنه الأقوى حمضية وقاعدته القرينة (ClO4–) تكون الأضعف قاعدية بمعني أن العلاقة بين الحمض وقاعدته القرينة علاقة عكسية.
لماذا سميت الأحماض المعدنية بهذا الأسم رغم عدم احتوائها على معادن
هناك أختلاف بين كلمة (Mineral) وبين كلمة (Metal): المعادن هي المواد العادية المعروفة في الجدول الدوري، أما المعادن الصلبة غير العضوية فتسمى المعادن، وهي تتكون بشكل طبيعي دون تدخل بشري ويمكن العثور عليها في قشرة الأرض، ولها تركيب كيميائي وهيكل بلوري.
تتألف الأحماض المعدنية من أملاح معدنية، حيث يأتي حمض الهيدروكلوريك من الملح الطعام، وحمض الكبريتيك من الكبريت، وحمض الكبريتوز هو الحمض الأكسجيني للكبريت، وحمض الفوسفوريك من الفوسفور، وحمض النيتريك من النترات، وكل حمض له حكاية وقصة مختلفة تتعلق بمصدره وتكوينه.
ما هو الحمض القوي
- الحمض القوي هو الحمض الذي يمكنه إعطاء أكبر عدد من أيونات H+ أو بروتونات عندما يتأين تمامًا في المحلول، وهذه الأيونات هي الجسيمات المشحونة التي تجعل الحمض موصلاً للكهرباء.
- يمكن أن تبجيل هذه التفاعلات الكيميائية، ولكن يحدث هذا في حالات قليلة، وقتها يتخلص من الحمض H+ من أيون بسهولة، ويتم فصل الحمض بالكامل.
- توضيح بمثال: إذا ذاب كلوريد الهيدروجين في H2O لكى يصنع حمض الهيدروكلوريك، يحدث القليل من التفاعل العكسي، وفي وقت واحد، يمكن أن يحدث تفاعلاً افتراضياً مائة بالمائة حيث يظهر كلوريد الهيدروجين في تفاعل مع H3O+ (أيون الهيدروكسونيوم) و(Cl– أيونات)، في تلك الحالة يكون الحمض القوي هو كلوريد الهيدروجين.
- لا يمكن ذكر الأحماض القوية دون ذكر أقوى حمض في العالم، وهو حمض الفلوروأنتيمونيك، ويعرف الحمض الفائق على أنه حمض لديه حموضة أعلى من حمض الكبريت، وحمض الكاربورين (حمض الفحم)، وهو أول حمض فائق يمكن حفظه في وعاء.
أمثلة على الأحماض المعدنية القوية
تتفكك أيونات الأحماض القوية تمامًا في الماء، مما يؤدي إلى إصدار بروتون واحد أو أكثر (كاتيونات الهيدروجين) لكل جزيء، وهناك 7 أحماض قوية مشتركة في ذلك:
- حمض الهيدروكلوريك
- HI – حامض هيدرويدي
- HBr – حمض الهيدروبروميك
- HClO 4 – حمض البيركلوريك
- H 2 SO 4 – حامض الكبريتيك
- HClO 3 – حمض الكلوريك
- HNO 3 – حمض النيتريك
ما هو الحمض الضعيف
هو أقل قدرة في إعطاء البروتونات مقارنة بالحمض القوي.حيث يؤكد الكيميائيون أن الحمض ضعيف هو الحمض الذي إذا تأين نتج تأين جزئي أو غير كامل، وبالتالي ينتج عن هذا التأين إطلاق لبعض ذرات الهيدروجين فقط في المحلول. وبالتالي، تحتوي الأحماض الضعيفة على pKa أعلى من الأحماض القوية.
أمثلة على الأحماض المعدنية الضعيفة
من الأمثلة الجيدة على حمض ضعيف هو حمض إيثانويك، الذي يظهر تفاعل مع H2O فينتج عن التفاعل H3O+ (أيونات الهيدروكسونيوم) و CH3COOH (أيونات الإيثانوات)، ولكن ما يميز هذا التفاعل هو التفاعل العكسي الذي يُظهر نجاحاً أكبر من التفاعل الأمامي. حيث تتفاعل الجزيئات بسهولة تامة لتحسين الحمض.
- حمض الفوسفوريك
- حمض الخليك (CH3COOH)
- حامض الكبريتيك
- حمض الهيدروفلوريك (HF)
- حمض الفورميك (HCOOH)
- حمض النيتروز (HNO)2)
- حمض البنزويك
الفرق بين الحمض القوي والحمض الضعيف
| الحمض القوي | الحمض الضعيف | |
| التوصيل الكهربي | تكون الأحماض القوية دائمًا موصلة قوية للتيار الكهربائي، حيث يمر التيار عادة بمعدل أكبر في الأحماض القوية مقارنة بالأحماض الضعيفة لنفس الجهد والتركيز | يتميز الموصلون الضعيفون بمقدرتهم الضعيفة على توصيل التيار الكهربائي، ولذلك يطلق عليهم الموصلات الفقراء. |
| الرقم الهيدروجيني | يكون الرقم الهيدروجيني منخفضًا، عادةً 3، ويكون تركيز الأحماض القوية من أيونات H + عاليًا، حيث يحتوي الحمض الذي يحمل الرقم الهيدروجيني 3 على 0.001 مول من أيونات الهيدروجين لكل لتر من المحلول | الحمض الضعيف يحتوي على درجة حموضة تتراوح بين 3-7. |
| نسبة التفاعل | يتميز الحمض القوي بقدرته على التفاعل بشكل أسرع | يتميز الحمض الضعيف بمعدل أبطأ في التفاعل |
| قيمة pKa | تكون قيمة pKa منخفضة جدا في الحمض القوي . | تكون قيمة pKa عالية جدًا في الأحماض الضعيفة. |
تأين الأحماض الضعيفة
يعتبر الكيميائيون أن سهم التفاعل لتأين الحمض القوي في الماء سهمًا بسيطًا من اليسار إلى اليمين. وعلى عكس ذلك بالنسبة لحامض ضعيف تجد إن سهم التفاعل متأين في الماء هو سهم مزدوج، مما يدل على أنه عند التوازن يحدث كلا من التفاعل الأمامي والعكسي، عندما يكون القاعدة المترافقة والحمض الضعيف وأيون الهيدروجين متوفر في المحلول المائي.
الشكل العام لتفاعل التأين هو: HA ⇌ H + + A –
مثال توضيحي: يتمثل التفاعل الكيميائي لحمض الأسيتيك في الصيغة التالية:
H 3 COOH ⇌ CH 3 COO – + H +
القاعدة المترافقة مع حمض الأسيتيك هي أسيتات الأسيتات (على الجانب الأيمن / المنتج).
الفرق بين الأحماض المعدنية والأحماض العضوية
تعرف الأحماض على أنها تلك المركبات الكيميائية التي لها خصائص حمضية. ويمكن تعريف الحمض على أنه نوع كيميائي لديه القدرة على أن يتفاعل مع قاعدة، وينتج عن التفاعل ملح وماء، ويمكن أيضاً أن تصنف الأحماض على أنها أحماض معدنية وأحماض عضوية وذلك يتوقف على التركيب الكيميائي للحمض.
الفرق الأساسي بين الأحماض العضوية والأحماض المعدنية هو أن الأحماض المعدنية هي مركبات غير عضوية تكون من مجموعات مختلفة من العناصر الكيميائية، بينما تكون الأحماض العضوية من مركبات عضوية تتكون في الأساس من ذرات الكربون والهيدروجين.